МИНИСТЕРСТВО ОБОРОНЫ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГЛАВНОЕ ВОЕННО-МЕДИЦИНСКОЕ УПРАВЛЕНИЕ
СОВРЕМЕННЫЕ ФИБРИНОЛИТИКИ
В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ И
ПОВРЕЖДЕНИЙ ОРГАНА ЗРЕНИЯ
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Москва 2006
В методических рекомендациях отражена характеристика тромбообразования и фибринолиза, показана роль современных фибринолитических ферментов в лечении заболеваний и травм органа зрения, сопровождающихся геморрагиями и фибринообразованием. Даны рекомендации по практическому применению тромбо- и фибринолитического препарата последнего поколения — «Гемазы», созданного на основе современных биотехнологий с применением методов генной инженерии.
Определены показания и противопоказания к применению, а также описаны методики, дозировки и оптимальные способы введения препарата «Гемаза» при различных патологических состояниях.
Методические рекомендации предназначены для врачей-офтальмологов Вооруженных Сил Российской Федерации, обучающихся и практикующих врачей-офтальмологов.
Методические рекомендации подготовлены начальником кафедры офтальмологии Военно-медицинской академии — главным офтальмологом МО РФ, доктором медицинских наук профессором полковником медицинской службы Э.В. Бойко; начальником НИЛ «Микрохирургии глаза и контактной коррекции зрения» при кафедре офтальмологии Военно-медицинской академии доктором медицинских наук профессором В.Ф. Даниличевым; преподавателем кафедры офтальмологии Военно-медицинской академии подполковником медицинской службы Т.Г. Сажиным.
Рецензент — старший научный сотрудник НИЛ «Микрохирургии глаза и контакт-
ной коррекции зрения» при кафедре офтальмологии Военно-медицинской академии
доктор медицинских наук профессор Н.А. Ушаков
ВВЕДЕНИЕ
Внутриглазные кровоизлияния и выпот фибрина относятся к числу тяжелых осложнений различных заболеваний и повреждений глаз. Наиболее частой причиной их возникновения являются ранения и контузии глазного яблока. Наряду с этим заболевания внутренних оболочек глаза также ведут к кровоизлияниям и выпоту фибрина.
Так, травма глаза от 30% до 80% случаев осложняется внутриглазными геморрагиями (Гундорова Р.А., 1991; Даниличев В.Ф., 2000). Увеиты различной этиологии в 62-88% сопровождаются выраженным помутнением стекловидного тела из-за выпота фибрина (Кацнельсон JI.A., Танковский В.Э., 1998).
Так, травма глаза от 30% до 80% случаев осложняется внутриглазными геморрагиями (Гундорова Р.А., 1991; Даниличев В.Ф., 2000). Увеиты различной этиологии в 62-88% сопровождаются выраженным помутнением стекловидного тела из-за выпота фибрина (Кацнельсон JI.A., Танковский В.Э., 1998).
В последние десятилетия в связи с общим ростом сосудистой патологии отмечается значительное увеличение числа случаев острых нарушений кровообращения в сосудах органа зрения. Общая распространенность тромботических поражений сетчатки от 1,3-1,6% до 3,1- 4,6% (Mitchell Р. с соавт., 1996; Klein R., 2000; Танковский В.Э., 2000) в популяции.
Зачастую внутриглазные манипуляции даже самыми современными инструментами (факоэмульсификатор, витреотом, эндолазер) осложняются внутриглазным выпотом фибрина, получившим в литературе название фибриноидного синдрома
(Han D.P., et al., 1990; Судовская Т.В., 1993). Токсико-аллергическая реакция в послеоперационном периоде у больных после экстракции катаракты с имплантацией ИОЛ по данным различных авторов (Ставничук Е.З., 1989; Федоров С.Н. с соавт., 1992;
Веселовская З.Ф., 2002) возникает с частотой от 3-7% до 21-33%. Частота фибриноидного синдрома, сопровождающего эндовитреальные манипуляции достигает 32%-35% (JaffeG.J., et al., 1990).
(Han D.P., et al., 1990; Судовская Т.В., 1993). Токсико-аллергическая реакция в послеоперационном периоде у больных после экстракции катаракты с имплантацией ИОЛ по данным различных авторов (Ставничук Е.З., 1989; Федоров С.Н. с соавт., 1992;
Веселовская З.Ф., 2002) возникает с частотой от 3-7% до 21-33%. Частота фибриноидного синдрома, сопровождающего эндовитреальные манипуляции достигает 32%-35% (JaffeG.J., et al., 1990).
Длительное нахождение крови и фибрина в передней камере и стекловидном теле изменяет и усугубляет течение основного заболевания. Возникает опасность токсического и механического воздействия на окружающие ткани, необратимого снижения
зрительных функций (Волков В.В. с соавт., 1990).
зрительных функций (Волков В.В. с соавт., 1990).
Комплексная консервативная терапия этих патологических состояний требует широкого применения фибринотромболитических препаратов (Даниличев В.Ф., 1996).
КРАТКОЕ ОПИСАНИЕ ФИБРИНООБРАЗОВАНИЯ И ФИБРИНОЛИЗА
В организме, в условиях биологического равновесия для обеспечения нормального гемостаза, функционируют две мощные системы — система тромбообразования и система тромболиза, которые действуют с участием клеток крови, а также плазменных
и тканевых ферментативных систем. По современным представлениям запуск системы тромбообразования может происходить двумя путями: внутренним и внешним.
и тканевых ферментативных систем. По современным представлениям запуск системы тромбообразования может происходить двумя путями: внутренним и внешним.
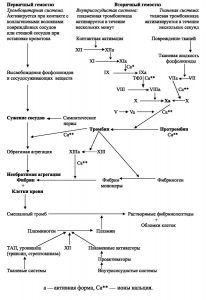
Принципиальная схема свертывающей и
фибринолитической систем (Ткаченко В.И., 1994)
фибринолитической систем (Ткаченко В.И., 1994)
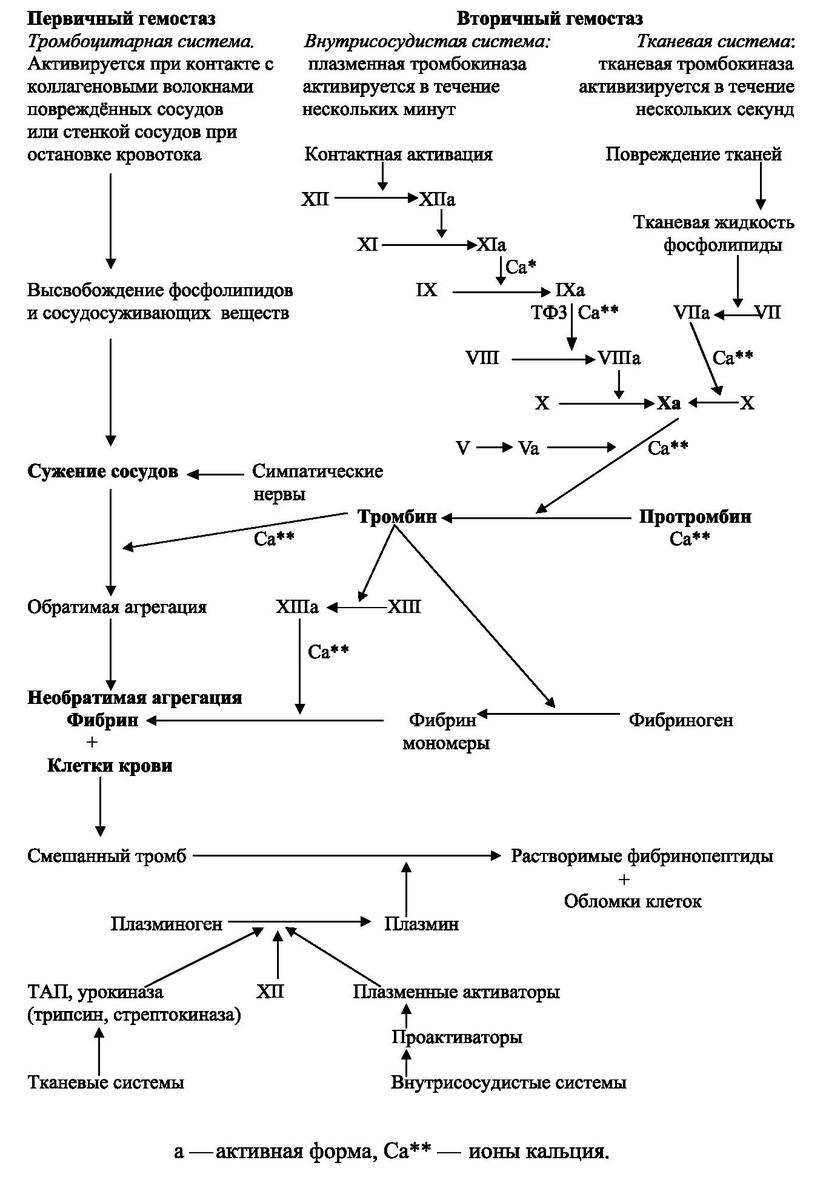
Внутренний путь связан с активацией плазменной тромбокиназы сосудистого русла, а внешний — с активацией тканевой тромбокиназы. Развивается своеобразная цепная реакция, первым звеном которой является активация XII фактора свёртываемости
крови (фактора Хагемана). Этот фактор при соприкосновении с повреждённой поверхностью сосуда или какой-либо смачиваемой чужеродной поверхностью превращается в активную форму. Активный XII фактор вызывает ряд последовательных реакций активации, в результате которых вовлекаются другие белковые факторы крови (XI, IX, VII, VIII, IV, X). В результате сложного взаимодействия вышеперечисленных факторов, а также ионов Са** происходит образование активного X фактора. Затем под влиянием комплекса факторов X, V, ТФЗ и ионов Са** происходит образование тромбина из протромбина.
крови (фактора Хагемана). Этот фактор при соприкосновении с повреждённой поверхностью сосуда или какой-либо смачиваемой чужеродной поверхностью превращается в активную форму. Активный XII фактор вызывает ряд последовательных реакций активации, в результате которых вовлекаются другие белковые факторы крови (XI, IX, VII, VIII, IV, X). В результате сложного взаимодействия вышеперечисленных факторов, а также ионов Са** происходит образование активного X фактора. Затем под влиянием комплекса факторов X, V, ТФЗ и ионов Са** происходит образование тромбина из протромбина.
Далее под влиянием фермента тромбина от фибриногенаотщепляются два пептида А и два пептида В. После отщепления пептидов, получивших название фибрин-пептиды, фибриноген превращается в фибрин-полимер.
Превращение фибрин-мономера в фибрин-полимер протекает с участием фибринстабилизирующего фактора XIII в присутствии ионов Са**.
В состав сосудистого тромба входят клетки крови и фибрин-полимер. За пределами сосудистого русла (в тканях и полостях), если не нарушена целостность сосудистой стенки, образуется только фибриновый сгусток, в котором нет клеток крови. Повышение проницаемости сосудистой стенки при различных патологических состояниях приводит к выходу из сосудов в ткани факторов плазмы крови и образованию фибринового сгустка (Петрищев Н.Н., 1990).
Вторая система — система фибринолиза — обеспечивает возможность растворения уже сформировавшихся сгустков. Образующийся фибрин откладывается внутри или вне сосудов. Процессы разрушения и выведения отложений фибрина играют важную роль. В этих процессах участвуют протеолитические ферменты, особенно те, которые относятся к плазминоген — плазминовой системе. Центральное место в системе ферментативного фибринолиза занимают процессы активации плазминогена с образованием активного протеолитического фермента — плазмина. Это происходит вследствие отщепления от NH2 — концевой части молекулы профермента пептида или пептидов, молекулярная масса которых около 7000. На втором этапе активации в центре молекулы расщепляется аргинин-валиновая связь и образуется молекула плазмина, состоящая из двух цепей, которые соединяются между собой одним или двумя дисульфидными мостиками. Вещества, способные вызывать эту реакцию, обычно называют активаторами плазминогена. Именно эти препараты, имея высокую терапевтическую эффективность и минимальное побочное действие, используются в лечебных методиках имитации в организме естественной цепной реакции активации фибринолитической системы, осуществляемой путём введения ряда агентов.
Активация плазминогена происходит двумя путями — внутренним и внешним. Медиатором внутреннего пути активации плазминогена является активный XII фактор свертывания крови. Активация плазминогена внешним путём происходит в результате выделения в кровь тканевых активаторов. Наиболее важным физиологическим источником тканевых активаторов является эндотелий сосудов. В ответ на слабые воздействия (стресс, упражнения, сдавления вен) эндотелиальные клетки выделяют определённое количество этих активаторов, а если стимуляция не прекращается, то клетки эндотелия способны их синтезировать. Различают два типа активаторов плазминогена: тканевого типа, который характерен для плазмы крови, и урокиназного типа, присутствующего в значительном количестве в моче. И первый, и второй, синтезируются в различных типах клеток и присутствуют в различных жидкостях организма, однако могут встречаться совместно в одних и тех же тканях и являются тождественными физиологическими активаторами. Считается, что фибринолитическая активность обоих примерно одинакова.
РОЛЬ СИСТЕМЫ ГЕМОСТАЗА В ОФТАЛЬМОПАТОЛОГИИ
Некоторые соматические заболевания (сахарный диабет, системная артериальная гипертензия, лучевая болезнь, болезнь Коатса, различные виды коллагенозов) способствуют развитию ряда заболеваний органа зрения и сопровождаются изменениями в свёртывающей и фибринолитической системах. Имеются данные о значении генерализованных гемостатических нарушений в патогенезе эмболий, тромбозов ретинальных сосудов, различных форм хориоретинальных дистрофий, поражений сосудов сетчатки и хориоидеи при эндокринных и инфекционно-аллергических заболеваниях.
Кроме того, нарушение динамического равновесия между свёртывающей и фибринолитическими системами крови играет важную роль в развитии геморрагических и тромбоэмболических осложнений при хирургическом лечении ряда заболеваний органа зрения.
С другой стороны, часть офтальмопатологии сопровождается изменениями концентрации и активности компонентов свёртывающей и фибринолитической систем в тканях глаза. Локальный гемостаз поддерживается не только соответствующими факторами крови, но и таковыми в структурах глаза. Ткани и жидкости интактного глаза человека содержат компоненты, обеспечивающие динамическое равновесие между свёртывающей и фибринолитической системами и возможность при необходимости активации или ингибирования каждой из них. В сетчатке, сосудистой и склеральной оболочках содержатся соединения, регулирующие скорость свёртывания крови и лизис уже сформировавшихся сгустков. Исследования фибринолитической активности тканей глаза показали, что в них содержатся активаторы и ингибиторы фибринолиза.
Так, экстракты сосудистой, сетчатой оболочки и конъюнктивы содержат активаторы плазминогена, роговица, радужка и склера проявляют лишь незначительные фибринолитические свойства, в то время как влага передней камеры, стекловидное тело,
хрусталик обладают выраженной антифибринолитической активностью. Тонкие иммуноферментные и цитохимические методы анализа позволяют не только установить факт наличия, но и определить концентрацию компонентов фибринолитической системы в структурах глаза. Так, значительный уровень активатора плазминогена урокиназного типа обнаружен в эндотелии роговицы, эписклере, склере, мышцах радужки, экваториальной области и в задней капсуле хрусталика, периферических отделах стекловидного тела, эпителии плоской части цилиарного тела, пигментном эпителии сетчатки, волокнах зрительного тела, увеальных фибробластах и экстраокулярных мышцах. Низкие концентрации урокиназы выявлены в конъюнктивальном и роговичном эпителии, трабекулярной зоне, меланоцитах, строме радужки и сосудистой оболочке, в задних слоях сетчатки. В строме роговицы, бокаловидных клетках конъюнктивы и в центральной части хрусталика урокиназа не обнаружена (Tripathi R.C., Tripathi B.J.,
хрусталик обладают выраженной антифибринолитической активностью. Тонкие иммуноферментные и цитохимические методы анализа позволяют не только установить факт наличия, но и определить концентрацию компонентов фибринолитической системы в структурах глаза. Так, значительный уровень активатора плазминогена урокиназного типа обнаружен в эндотелии роговицы, эписклере, склере, мышцах радужки, экваториальной области и в задней капсуле хрусталика, периферических отделах стекловидного тела, эпителии плоской части цилиарного тела, пигментном эпителии сетчатки, волокнах зрительного тела, увеальных фибробластах и экстраокулярных мышцах. Низкие концентрации урокиназы выявлены в конъюнктивальном и роговичном эпителии, трабекулярной зоне, меланоцитах, строме радужки и сосудистой оболочке, в задних слоях сетчатки. В строме роговицы, бокаловидных клетках конъюнктивы и в центральной части хрусталика урокиназа не обнаружена (Tripathi R.C., Tripathi B.J.,
Park J.К., 1990). Тканевой активатор илазминогена обнаружен в роговичном эпителии, эндотелии, цилиарном теле, радужке, во влаге передней камеры и в клетках трабекулярной ткани глаза человека. С помощью гистоиммунных методов доказана локализация тканевого активатора плазминогена в артериях и артериолах периферических отделов сетчатки, венах и артериях сосудистой оболочки.
ПРИМЕНЕНИЕ ФИБРИНОЛИТИКОВ В ЛЕЧЕБНЫХ ЦЕЛЯХ
Наиболее эффективно усиливать фибринолиз в терапевтических целях удаётся путем применения естественных активаторов плазминогена. Среди этих лекарственных препаратов наиболее эффективны ферментные активаторы эндогенного фибринолиза — активаторы плазминогена урокиназного и тканевого типа, а также стрептокиназа.
СТРЕПТОКИНАЗА
Стрептокиназа является продуктом обмена В-гемолитических стрептококков.
Молекулярная масса вещества невысока и колеблется от 40000 до 50000, что обеспечивает возможность её проникновения во внесосудистые русла (Чазов Е. И., Лакин К. М., 1977). Стрептокиназа не считается протеолитическим ферментом, так как не переваривает казеин или желатин, что было впервые открыто R. Т. Garner, W S. Tillett (1934) и в настоящее время общепринято (Имшенецкий А. А., 1981).
Молекулярная масса вещества невысока и колеблется от 40000 до 50000, что обеспечивает возможность её проникновения во внесосудистые русла (Чазов Е. И., Лакин К. М., 1977). Стрептокиназа не считается протеолитическим ферментом, так как не переваривает казеин или желатин, что было впервые открыто R. Т. Garner, W S. Tillett (1934) и в настоящее время общепринято (Имшенецкий А. А., 1981).
Стрептокиназа активирует плазминоген, способствуя его переходу в плазмин.
Эта активация зависит от специфического комплекса между стрептокиназой и плазминогеном, способного активировать плазминоген (Чазов Е.И., 1977). Стрептокиназа при введении в переднюю камеру глаза при травматической гифеме повышает
фибринолитическую активность влаги передней камеры, причём в большей степени, чем фибринолизин, и в меньшей степени, чем урокиназа. По данным А.Д. Ромащенко с соавт. (1979), стрептокиназа способствует рассасыванию травматического гемофтальма и препятствует возникновению рецидива кровоизлияния в стекловидноетело. Стептокиназа с гепарином успешно применялась при лечении тромбоза ретинальныхсосудов (Шастина Е.А., 1981; Писаренко С.Л., 1982; HohlmannG. etal., 1973).
Экспериментальное изучение и клиническое применение иммобилизированной стрептокиназы — стрептодеказы показано в работах Р.А.Гундоровой с соавт. (1986), Б.В.Москвичёва (1990).
Эта активация зависит от специфического комплекса между стрептокиназой и плазминогеном, способного активировать плазминоген (Чазов Е.И., 1977). Стрептокиназа при введении в переднюю камеру глаза при травматической гифеме повышает
фибринолитическую активность влаги передней камеры, причём в большей степени, чем фибринолизин, и в меньшей степени, чем урокиназа. По данным А.Д. Ромащенко с соавт. (1979), стрептокиназа способствует рассасыванию травматического гемофтальма и препятствует возникновению рецидива кровоизлияния в стекловидноетело. Стептокиназа с гепарином успешно применялась при лечении тромбоза ретинальныхсосудов (Шастина Е.А., 1981; Писаренко С.Л., 1982; HohlmannG. etal., 1973).
Экспериментальное изучение и клиническое применение иммобилизированной стрептокиназы — стрептодеказы показано в работах Р.А.Гундоровой с соавт. (1986), Б.В.Москвичёва (1990).
Однако, стрептокиназа продуцируется В-гемолитическим стрептококком и из-за этого имеет повышенную антигенность. Ряд авторов (Коллен Д., Уимен Б., 1989 и др.) указывают на возможность побочных эффектов при применении стрептокиназы, так
как не исключено, что в плазме пациента находятся антитела против стрептокиназы — бактериального белка, который используют для активации фибринолиза in vivo. Они образуются вследствие перенесённых ранее инфекционных заболеваний, вызванных В-гемолитическим стрептококком, продуцирующим стрептокиназу. В связи с этим для активации фибринолиза приходится вводить большое количество препарата стрептокиназы. Из-за этого возникают побочные аллергические реакции. Как указывает Е.К. Амирова (1991), применявшая стрептокиназу при лечении внутриглазных кровоизлияний, препарат в 27% случаев вызывал аллергическую реакцию.
как не исключено, что в плазме пациента находятся антитела против стрептокиназы — бактериального белка, который используют для активации фибринолиза in vivo. Они образуются вследствие перенесённых ранее инфекционных заболеваний, вызванных В-гемолитическим стрептококком, продуцирующим стрептокиназу. В связи с этим для активации фибринолиза приходится вводить большое количество препарата стрептокиназы. Из-за этого возникают побочные аллергические реакции. Как указывает Е.К. Амирова (1991), применявшая стрептокиназу при лечении внутриглазных кровоизлияний, препарат в 27% случаев вызывал аллергическую реакцию.
АКТИВАТОРЫ ПЛАЗМИНОГЕНА
Активаторы плазминогена урокиназного и тканевого типа являются естественными продуктами метаболизма в организме. Именно эти препараты — урокиназа и тканевой активатор плазминогена (ТАИ) — интенсивно изучаются как перспективные в
витреальной хирургии и для лечения внутриглазных кровоизлияний и фибринообразований (Cleary Р.Е. et al., 1974; Sellors P.J., et al. 1974; Бойко Э.В., 1994; Астахов Ю.С. с соавт., 1999; Даниличев В.Ф., 1996). Однако широкое применение этих препаратов
ограничивалось трудностями в получении и их дороговизной. В настоящее время благодаря успехам генной инженерии появилась возможность микробиологического синтеза данных препаратов в необходимом количестве.
витреальной хирургии и для лечения внутриглазных кровоизлияний и фибринообразований (Cleary Р.Е. et al., 1974; Sellors P.J., et al. 1974; Бойко Э.В., 1994; Астахов Ю.С. с соавт., 1999; Даниличев В.Ф., 1996). Однако широкое применение этих препаратов
ограничивалось трудностями в получении и их дороговизной. В настоящее время благодаря успехам генной инженерии появилась возможность микробиологического синтеза данных препаратов в необходимом количестве.
ТКАНЕВОЙ АКТИВАТОР ПЛАЗМИНОГЕНА
Тканевой активатор плазминогена активно изучался в 90-е годы прошлого века. Исследовались дозы, методы введения, эффективность и побочные действия препарата. W.K. Minetal., (1990), N. Baziuketal., (1991), J.D. Benneretal., (1992), Астахов Ю.С.
с соавт., (1999) отмечают высокую эффективность ТАИ при лечении гифемы и гемофтальма при минимальных побочных действиях.
с соавт., (1999) отмечают высокую эффективность ТАИ при лечении гифемы и гемофтальма при минимальных побочных действиях.
Представляют интерес работы J. Moon et al., (1992), Н. Lewis et al., (1994), L.M. Manning et al., (1994), T. Starek et al., (1995), указывающие на способность ТАП лизировать фибрин, образующийся после витрэктомии, при введении его в переднюю
камеру или в стекловидное тело после операции. M.W. Johnson et al., (1988) исследовали влияние различных доз фермента при внутриглазном его введении на рассасывание фибрина.
камеру или в стекловидное тело после операции. M.W. Johnson et al., (1988) исследовали влияние различных доз фермента при внутриглазном его введении на рассасывание фибрина.
ТАП имеет несколько теоретических преимуществ по сравнению со стрептокиназой, так как не имеет антигенных свойств. ТАП заметно активизируется в присутствии фибрина (то есть в сгустке) и относительно бездействует в присутствии фибриногена,
поэтому серьёзные геморрагические осложнения менее вероятны, чем при применении стрептокиназы (Tripathi R.C., 1988).
поэтому серьёзные геморрагические осложнения менее вероятны, чем при применении стрептокиназы (Tripathi R.C., 1988).
Однако, эти потенциальные преимущества ТАП убедительно не проявляются при системном использовании. ТАП не уменьшает частоту геморрагических осложнений,возможно из-за сопутствующего использования гепарина. Короткий период полураспада ТАП может рассматриваться терапевтическим неудобством, которое ведет к прекращению фибринолиза и необходимости повторного введения препарата. ТАП гораздо более дорог, чем другие фибринолитические средства.
Наряду с сообщениями о высокой эффективности ТАП в лечении внутриглазных кровоизлияний и при поствитрэктомическом образовании фибрина, имеются работы, указывающие на недостаточную эффективность при позднем введении препарата
(Folk J.С. et al., 1991), а также на серьёзные осложнения: рецидивы кровотечения, отслойка сетчатки, развитие катаракты (Dabbs С.К. et al., 1990).
(Folk J.С. et al., 1991), а также на серьёзные осложнения: рецидивы кровотечения, отслойка сетчатки, развитие катаракты (Dabbs С.К. et al., 1990).
УРОКИНАЗА
Протеолитическая активность мочи была обнаружена более 100 лет назад (Sahli J., 1885). D.F. Williams (1951) выяснил, что наблюдаемая фибринолитическая активность мочи, отличается от неспецифического протеолиза и имеет отношение к активации плазминогена. Такую активацию плазминогена Н. Sobel в 1952 году назвал урокиназной. Вопрос о происхождении урокиназы остаётся дискуссионным. Ранее считалось, что она представляет собой экскретируемый кровяной активатор. В ряде
исследований было показано, что активатор, образующийся в культуре почечных клеток эмбриона человека, по своим физико-химическим и иммунологическим свойствам идентичен урокиназе. Это свидетельствует о том, что урокиназа синтезируется в
почках.
исследований было показано, что активатор, образующийся в культуре почечных клеток эмбриона человека, по своим физико-химическим и иммунологическим свойствам идентичен урокиназе. Это свидетельствует о том, что урокиназа синтезируется в
почках.
Урокиназа повышает фибринолитическую активность крови благодаря активации плазминогена, переводя его в плазмин. При этом происходит расщепление аргининвалиновой связи в молекуле плазминогена. Фермент проникает внутрь тромба и там активирует плазминоген, адсорбированный на фибрине. Таким образом, тромболиз под влиянием урокиназы представляет собой комплексный процесс, в котором происходит как экзогенный, так и эндогенный лизис нитей фибрина.
Использование урокиназы для активации фибринолитической системы в лечебных целях имеет преимущества по сравнению с другими активаторами. Среди преимуществ выделяют следующие: фермент не антигенен, более фибринолитичен, чем стрептокиназа; способен вызывать длительное тромболитическое состояние, в отличие от ТАП; хорошо переносится, являясь естественным метаболитом человеческого организма; не вызывает ослабление гемостаза и уменьшение фибриногена; в отличие
от стрептокиназы, урокиназа не требует индивидуализированной дозы и тщательного лабораторного контроля.
от стрептокиназы, урокиназа не требует индивидуализированной дозы и тщательного лабораторного контроля.
В клинической практике урокиназу с успехом используют (Тартаковская А. И. с соавт., 1976; Даниличев В.Ф., 1983, 1999) при лечении больных с гифемой, внутриглазными кровоизлияниями, гемофтальмом и окклюзиями вен и артерий сетчатки.
Изучение нативной урокиназы и различных иммобилизированных форм свидетельствует о том, что используемые методы иммобилизации позволили сохранить значительную долю (30-100 %) каталитической активности урокиназы в иммобилизированных формах (Даниличев В.Ф. с соавт., 1992; Кольцова С.В. с соавт., 1991, 1995;
Бойко Э.В. с соавт., 1993).
Бойко Э.В. с соавт., 1993).
ПРОУРОКИНАЗА
Проурокиназа — неагрессивная нейтральная форма в виде профермента, вследствие этого обладает преимуществом вызывать фибринолиз только в присутствии фибрина.
Бойко Э.В. Даниличевым В.Ф. и Кольцовой С.В. (1992-1995) было впервые проведено изучение фармакокинетики и лечебной эффективности различных форм проурокиназы при фибриноидном синдроме, являющимся одним из наиболее тяжелых осложнений современной хирургии катаракты, стекловидного тела и сетчатки.
Результаты исследований показали, что интравитреальное введение проурокиназы позволяет лизировать внутриглазной фибриновый сгусток после ленсвитрэктомии и купировать фибриноидный синдром в пределах 1-2 сут при определенных экспериментально безопасных дозировках препарата 1000 — 5000 ME. Применение проурокиназы в раннем послеоперационном периоде не приводило к повреждению роговицы, внутриглазным кровоизлияниям и не увеличивало частоту возникновения отслойки сетчатки после витрэктомии.
Результаты исследований показали, что интравитреальное введение проурокиназы позволяет лизировать внутриглазной фибриновый сгусток после ленсвитрэктомии и купировать фибриноидный синдром в пределах 1-2 сут при определенных экспериментально безопасных дозировках препарата 1000 — 5000 ME. Применение проурокиназы в раннем послеоперационном периоде не приводило к повреждению роговицы, внутриглазным кровоизлияниям и не увеличивало частоту возникновения отслойки сетчатки после витрэктомии.
Также была установлена высокая фармакологическая активность и отсутствие побочных эффектов при применении нативной и иммобилизированной проурокиназы для лечения гемофтальма.
Данные экспериментальных работ послужили основой для разработки и внедрения в клиническую практику нового отечественного препарата «Гемаза», основным действующим началом которого является проурокиназа.
«Гемаза» представляет собой лиофилизированный ферментный препарат, содержащий рекомбинантную проурокиназу (РПУ), помещённую в инертный носитель, в состав которого входит декстран и хлорид натрия. Действующим началом препарата
«Гемаза» является рекомбинантная проурокиназа. Специфическая активность препарата составляет 80 000-100 000 ME на 1 мг белка. «Гемаза» хорошо растворяется в воде и изотоническом растворе хлорида натрия. Препарат «Гемаза» стерилен и апирогенен, расфасован в ампулы по 5000 ME в виде порошка. Непосредственно перед применением содержимое ампулы растворяется в 1 мл изотонического раствора хлорида натрия или в воде для инъекций, при этом получается концентрация 5000 ME в мл. В зависимости от способа применения используют: 0,1 мл раствора для интравитреального или для введения в переднюю камеру; 0,5 мл — для подконьюнктивальной, а 1,0 мл для парабульбарной и субтеноновой инъекции. При клиническом испытании «Гемазу» вводили: субконъюнктивально, парабульбарно, в субтеноново пространство, эндовитреально в дозе от 500 до 5000 ME от одного до десяти раз.
«Гемаза» является рекомбинантная проурокиназа. Специфическая активность препарата составляет 80 000-100 000 ME на 1 мг белка. «Гемаза» хорошо растворяется в воде и изотоническом растворе хлорида натрия. Препарат «Гемаза» стерилен и апирогенен, расфасован в ампулы по 5000 ME в виде порошка. Непосредственно перед применением содержимое ампулы растворяется в 1 мл изотонического раствора хлорида натрия или в воде для инъекций, при этом получается концентрация 5000 ME в мл. В зависимости от способа применения используют: 0,1 мл раствора для интравитреального или для введения в переднюю камеру; 0,5 мл — для подконьюнктивальной, а 1,0 мл для парабульбарной и субтеноновой инъекции. При клиническом испытании «Гемазу» вводили: субконъюнктивально, парабульбарно, в субтеноново пространство, эндовитреально в дозе от 500 до 5000 ME от одного до десяти раз.
При клинических испытаниях препарата «Гемаза» были проанализированы результаты эффективности применения фибринолитиков в лечении 280 больных (286 глаз), из них у 104 развилась (104 глаза) фибриноидная экссудативная реакция после экстракции катаракты, в 91 наблюдении (91 глаз) имел место тромбоз центральной вены сетчатки, и в 85 наблюдениях (91 глаз) гемофтальм при диабетической ретинопатии.
Возраст больных составлял от 65 до 78 лет. Каждая из групп была разбита на три подгруппы: в одной применяли "Гемазу", в другой фибринолизин, третья подгруппа была контрольной (в ней консервативное лечение проводилось без фибринолитиков). Срок наблюдения составил от 30 суток до трех месяцев.
До начала лечения средняя острота зрения в подгруппах статистически не различалась. В конце срока наблюдения средняя острота зрения в подгруппах, где применяли «Гемазу», была достоверно выше, чем в контрольной и в подгруппах с фибринолизином. При оценке переносимости препаратов местная аллергическая реакция была отмечена в 8 (10,7%) случаях только при введении фибринолизина и выражалась в неприятных ощущениях при субконъюнктивальном введении, появлении отека конъюнктивы и кожи век.
Таким образом, наибольшей специфической активностью и наименьшим числом осложнений из изученных фибринолитиков отличалась «Гемаза». Применение данного препарата позволяет в короткие сроки достичь повышения зрительных функций.
Отсутствие аллергических осложнений, по-видимому, объясняется отсутствием антигенных свойств у белка, входящего в состав препарата.
Отсутствие аллергических осложнений, по-видимому, объясняется отсутствием антигенных свойств у белка, входящего в состав препарата.
Анализ проводимого исследования показал, что средний срок рассасывания фибринового сгустка в передней камере после оперативных вмешательств составил 0,5 — 3 суток. Средний срок полного рассасывания даже тотальной гифемы, в результате
контузии или проникающего ранения, составил 1,5 — 4,5 суток. При рассасывании гемофтальма выраженный эффект появлялся к 7—14 суткам. К окончанию же наблюдения (1 мес.) острота зрения у таких больных в среднем увеличилась в два раза
(р<0,05). На основе проведенных исследований были выработаны показания к применению препарата.
контузии или проникающего ранения, составил 1,5 — 4,5 суток. При рассасывании гемофтальма выраженный эффект появлялся к 7—14 суткам. К окончанию же наблюдения (1 мес.) острота зрения у таких больных в среднем увеличилась в два раза
(р<0,05). На основе проведенных исследований были выработаны показания к применению препарата.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
И ОСОБЕННОСТИ ИСПОЛЬЗОВАНИЯ «ГЕМАЗЫ»
И ОСОБЕННОСТИ ИСПОЛЬЗОВАНИЯ «ГЕМАЗЫ»
Иридоциклит
Фибринозно-пластический иридоциклит сопровождается выпотом воспалительного экссудата в переднюю камеру или формированием фибриноидных сращений.
Поэтому первоочередной задачей лечения является ликвидация задних синехий и рассасывание фибрина в передней камере. Для этих целей оптимальным сочетанием является применение мощных фибринолитиков, в частности «Гемазы», противовоспалительного препарата — дексаметазона, и мидриатиков — атропина и мезатона. Под конъюнктиву в смеси в одном шприце вводят дексамезатона 0,4% раствор — 0,3 мл, атропина 0,1% раствор — 0,2 мл, мезатона 1% раствор — 0,2 мл. После этого через 30-40 мин субконъюнктивально инъецируют 0,5 мл раствора "Гемазы" (5000 ME в 1 мл).
Инъекции (ориентировочно 3-5) продолжают до рассасывания фибрина и ликвидации задних синехий. Одновременно проводят терапию, включающую антибиотики и противовоспалительные препараты и продолжают её даже после рассасывания фибрина
до полного стихания воспалительного процесса.
Поэтому первоочередной задачей лечения является ликвидация задних синехий и рассасывание фибрина в передней камере. Для этих целей оптимальным сочетанием является применение мощных фибринолитиков, в частности «Гемазы», противовоспалительного препарата — дексаметазона, и мидриатиков — атропина и мезатона. Под конъюнктиву в смеси в одном шприце вводят дексамезатона 0,4% раствор — 0,3 мл, атропина 0,1% раствор — 0,2 мл, мезатона 1% раствор — 0,2 мл. После этого через 30-40 мин субконъюнктивально инъецируют 0,5 мл раствора "Гемазы" (5000 ME в 1 мл).
Инъекции (ориентировочно 3-5) продолжают до рассасывания фибрина и ликвидации задних синехий. Одновременно проводят терапию, включающую антибиотики и противовоспалительные препараты и продолжают её даже после рассасывания фибрина
до полного стихания воспалительного процесса.
Послеоперационный выпот фибрина в переднюю камеру
Частым осложнением в послеоперационном периоде после экстракции катаракты или антиглаукоматозной операции является выпот фибрина в переднюю камеру, что приводит к медленному восстановлению зрительных функций и офтальмогипертензии.
В ответ на вмешательство возникает воспалительная реакция, которая регулируется нейрорефлекторно и с помощью химических медиаторов. Она включает: вазодилятацию (возникновение гиперемии, прилив крови к цилиарному телу); увеличение сосудистой проницаемости (приводящей к отёку, выходу белков крови, в том числе фибриногена) и клеточную инфильтрацию (проникновение клеток в переднюю камеру, возникновение в выраженных случаях гипопиона).
Эффективное лечение таких осложнений требует назначения мощной противовоспалительной терапии в сочетании с введением фибринолитиков. Рекомендуется использование «Гемазы» в виде субконьюнктивальных инъекций в дозе 5000 ME один раз в день в течение 5-7 дней или инстиляции в конъюнктивальную полость раствора «Гемазы» в концентрации 1000 ME в 1 мл физиологического раствора. Инстиляции проводят в течение 3 часов через каждые 10-15 мин, такой интенсивный режим повторяют ежедневно на протяжении 5-7 дней.
Необходимо дифференцировать асептический выпот фибрина в переднюю камеру после оперативного вмешательства от инфекционого иридоциклита или эндофтальмита, в этих случаях основным направлением терапии должно быть применение антибактериальных средств.
Послеоперационный выпот фибрина
в стекловидную камеру
в стекловидную камеру
Витреоретинальная хирургия при заболеваниях и повреждениях глаз, а также другие операции, связанные с вскрытием глазного яблока (экстракапсулярная экстракция катаракты, антиглаукоматозные вмешательства) могут осложниться образованием фибринового сгустка в стекловидной камере глаза. Выпот фибрина наиболее выражен на предрасположенных к этому глазах с повышенной проницаемостью стенок сосудов, например, при тяжёлых травмах, эндофтальмите, пролиферативной диабетической ретинопатии, пролиферативной витреоретинопатии. Хирургические вмешательства в таких случаях приводят к дополнительной травме тканей и повреждению гематоофтальмического барьера, что ведёт к запуску цепи биохимических реакций с образованием внутриглазного фибрина. Уже в ближайшем послеоперационном периоде осмотр и оценка внутриглазных структур затруднены, возможно появление отслойки сетчатки и других осложнений. При недостаточно быстром рассасывании фибриновых сгустков и плёнок, они могут служить основой для миграции и фиксации фибробластов, и последующей пролиферации. Фибрин, как было показано в исследованиях на тканевых культурах, способствует миграции и морфологическому изменению клеток пигментного эпителия сетчатки, которые формируют тяжи, способные сокращаться и оказывать тракционное воздействие на сетчатку и цилиарное тело.
Нередко наблюдается формирование фибриновой трансцилиарной мембраны, располагающейся позади хрусталика, его остатков или зрачка и прикрепляющейся к цилиарному телу. Она может вызвать нарушение оттока внутриглазной жидкости с по
вышением внутриглазного давления, переднему смещению периферической сетчатки, передней пролиферативной витреоретинопатии (Шишкин М.М., 2002).
вышением внутриглазного давления, переднему смещению периферической сетчатки, передней пролиферативной витреоретинопатии (Шишкин М.М., 2002).
На фоне традиционного лечения в виде стероидных и нестероидных противовоспалительных средств (для стабилизации гематоофтальмического барьера) назначаются фибринолитики в виде подконъюнктивальных и парабульбарных инъекций, в частности, по 0,5 мл раствора «Гемазы» в концентрации 5000 ME в 1 мл. При этом не всегда удаётся добиться лизиса фибриновых образований, особенно при их локализации в зрачковой зоне. Очевидно, это связано с невозможностью достичь терапевтических концентраций фибринолитиков для воздействия на сгустки мишени при экстраокулярных методах введения препаратов (Даниличев В.Ф., 1996). В этом случае необходимо интравитреальное введение 0,1 мл раствора «Гемазы» в той же концентрации.
В случае появления начальных признаков развития инфекционного эндофтальмита обязательно этиотропное лечение.
Гифема
Геморрагии в переднюю камеру также являются показаниями для применения «Гемазы». При обширных и длительно не рассасывающихся гифемах показано её введение в переднюю камеру через парацентез роговицы инсулиновым шприцем (0,1мл
раствора с 500 ME).
раствора с 500 ME).
При свежих частичных травматических гифемах, рекомендуется субконьюнктивальное введение 0,5 мл «Гемазы», начиная с третьих суток от момента травмы один раз в день 7-10 дней. При рецидивирующей гифеме применение препарата
противопоказано.
противопоказано.
Гемофтальм
Показанием для применения «Гемазы» является частичный гемофтальм с сохранением перспектив на высокие зрительные функции. При субтотальном и тотальном гемофтальме лечение фибринолитиками малоэффективно и показано проведение витреагемэктомии.
При сахарном диабете рассасывание гемофтальма фибринолитиками не является основным лечением, так как гемофтальм — признак пролиферативной диабетической ретинопатии, при которой наиболее эффективным лечением признана панретинальная лазеркоагуляция сетчатки. Однако, для её проведения необходимо восстановить прозрачность оптических сред и усилить рассасывание фибрина, что является показанием к применению «Гемазы». При травматическом гемофтальме данное лечение может быть самостоятельным методом.
Эффективность применения «Гемазы» при длительно существующих (более 4 недель) кровоизлияниях не изучалась, возможно, ее введение следует сочетать с коллагенолитиками, так как по прошествии времени начинают формироваться коллагеновые фиброзные шварты.
Наиболее эффективным является введение препарата интравитреально в условиях операционной. На небольшом участке отсепаровывают конъюнктиву (либо сдвигают её относительно склеры), затем в 4 мм от лимба производят прокол склеры иглой от инсулинового шприца, в ходе манипуляции в ту же иглу вводят 0,1 мл раствора «Гемазы» в концентрации 5000 ME в 1 мл. Также необходимо введение препарата в виде субконъюнктивальных инъекций или парабульбарно в дозе 5000 ME один раз в день 7-10 дней.
Острое нарушение кровообращения в сосудах сетчатки
В основе острого нарушения кровообращения в сосудах сетчатки лежат три различных по своему патогенезу состояния: спазм, тромбоз и эмболия, причём истинная эмболия является наиболее редкой причиной закупорки артерий. Для вен, вследствие присущих им анатомо-функциональных особенностей, острые нарушения в основном обусловлены процессом тромбообразования. Следует отметить, что и при артериальной непроходимости тромбирование играет значительную роль, к первичному спазму может быстро присоединиться вторичный тромбоз, а эмбол может окутываться фибрином.
Терапевтические мероприятия при острых нарушениях артериального кровообращения сетчатки глаза имеют много общего с лечением тромбоза центральной вены сетчатки. В то же время различие патогенетических причин обтурации сосуда, клинических проявлений ишемии сетчатки и течения процесса обусловливает некоторые особенности тактики лечения и ведения больных с острыми расстройствами кровообращения в центральной артерии или вене сетчатки. Учитывая чрезвычайную чувствительность нервных элементов сетчатки к гипоксии, оказание лечебной помощи при острой непроходимости центральной артерии сетчатки следует отнести к числу ургентных мероприятий.
Консервативное лечение применяют при всех стадиях и типах тромбозов, а также в период развития осложнений. Но эффективность антитромботической терапии зависит от этиологии, давности венозной окклюзии и типа процесса.
Для выбора оптимальной терапии и достижения максимального эффекта необходимо: определить стадию тромбоза; выявить и устранить (или ослабить) действие этиологических факторов (например, снизить артериальное или внутриглазное давление);
совместно с врачом общего профиля осуществлять лечение основного заболевания.
совместно с врачом общего профиля осуществлять лечение основного заболевания.
При свежих случаях консервативное лечение должно быть направлено на восстановление кровотока в окклюзированном сосуде, устранение действия этиологических факторов, нормализацию местных и общих гематологических показателей, компенсацию метаболических нарушений.
В более отдаленные сроки от момента венозной окклюзии (1 мес. и более) целью консервативного лечения является предупреждение повторного тромбоза и окклюзивных заболеваний, как в парном глазу, так и в других органах.
Среди основных лекарственных веществ, применяемых при лечении больных с закупорками вен сетчатки, выделяют: кортикостероиды, тромбо — и фибринолитики, дезагреганты, антикоагулянты. Терапию больных с тромбозами вен сетчатки логично начинать с внутривенной гемодилюции с введением фибринолитических препаратов, глюкокортикоидов, при необходимости, сочетая со средствами, тормозящими агрегацию тромбоцитов, уменьшающими вязкость крови, а также прямыми антикоагулянтами. Рекомендовано субтеноновое введение «Гемазы» по 5000 ME в 1 мл с предварительной задней трепанацией склеры (далее — ЗТС), в последующем парабульбарные инъекции раствора.
ПРОТИВОПОКАЗАНИЯ
Основным противопоказанием для применения «Гемазы» является наличие инфекции с экссудативной реакцией. Однако, в таких случаях лечение антибиотиками при условии положительной динамики, можно сочетать с «Гемазой».
Относительным противопоказанием являются свежие, до 24-36 часов, геморрагии, сочетающиеся с выраженными системными изменениями гемостаза, так как в этот период сохраняется опасность рецидива кровоизлияния из-за возможного лизиса ещё не
сформировавшихся тромбов в повреждённых сосудах. Также относительными противопоказаниями являются такие тяжёлые сопутствующие заболевания, как геморрагические диатезы, инфекционный эндокардит, активная форма туберкулёза, хроничес-
кая почечная недостаточность, тяжёлая гепатоцелюлярная недостаточность.
сформировавшихся тромбов в повреждённых сосудах. Также относительными противопоказаниями являются такие тяжёлые сопутствующие заболевания, как геморрагические диатезы, инфекционный эндокардит, активная форма туберкулёза, хроничес-
кая почечная недостаточность, тяжёлая гепатоцелюлярная недостаточность.
ЗАКЛЮЧЕНИЕ
Таким образом, в арсенале офтальмологов появились новые эффективные средства для фибринолитической терапии, одним из которых является отечественный препарат «Гемаза». Их применение позволит повысить качество лечения и жизни пациентов с тяжелыми заболеваниями и повреждениями органа зрения.
ПРИЛОЖЕНИЕ
Показания, методы применения и дозы «Гемазы»
при заболеваниях и травмах органа зрения
при заболеваниях и травмах органа зрения
|
ПОКАЗАНИЯ
ДЛЯ ЛЕЧЕНИЯ |
МЕТОДЫ
ПРИМЕНЕНИЯ |
ДОЗА ПРЕПАРАТА
|
|
Передние серозные,
серознопластические увеиты различной этиологии. |
Инъекции под
конъюнктиву. |
0,5 мл раствора
концентрацией 5000 ME в 1 мл.
|
|
Экссудат
в передней камере в
послеоперационном периоде. |
Инъекции под
конъюнктиву. |
0,5 мл раствора
концентрацией 5000 ME в 1 мл.
Частые закапывания через каждые 10-15 минут раствора концентрацией 1000 ME в 1 мл. |
|
Выпот фибрина в
стекловидную камеру в послеоперационном
периоде. |
Инъекции под
конъюнктиву. Введение интравитреально. |
0,5 мл раствора
концентрацией 5000 ME в 1 мл.
0,1 мл раствора концентрацией 5000 ME в 1 мл
(доза 500 ME). |
|
Гифемы
посттравматические,
послеоперационные и другого генеза. |
Инъекции под
конъюнктиву. Введение в переднюю камеру. |
0,5 мл раствора концентрацией
5000 ME в 1 мл. 0,1 мл раствора концентрацией 5000 ME в 1 мл (доза 500 ME). |
|
Частичный или
полный гемофтальм различного происхождения. |
Введение
интравитреально, инъекции под конъюнктиву или ретробульбарно.
|
0,5 мл раствора концентрацией
5000 ME в 1 мл. Интравитреально 0,1 мл раствора
концентрацией 5000 ME в 1 мл (доза 500 ME), после чего ежедневно вводят под конъюнктиву или парабульбарно по 5000 ME в течение 7-10 дней. |
|
Острые
тромбоэмболические
процессы в глазу (непроходимость центральной артерии или вены сетчатки или их ветвей, нарушение кровообращения в стволе зрительного нерва). |
Введение в
субтеноново
пространство с
предварительным
выполнением
ЗТС,
парабульбарные
инъекции. |
Выполнение стандартной ЗТС и
введение 1 мл "Гемазы" в концентрации 5000 ME в 1 мл, в последующем ежедневные парабульбарные инъекции 0,5 мл раствора "Гемазы" в концентрации 5000 ME в 1 мл, в течение 10 дней. |
СПИСОК ЛИТЕРАТУРЫ
-
Амирова Э.Х. Опыт применения стрептодеказы для лечения внутриглазных кровоизлияний / Э.Х. Амирова, О.В. Дубилей // Вестн. офтальмол. — 1991. — Т. 107,
-
№6. — С. 35-36.
-
Астахов Ю.С. Использование тканевого активатора плазминогена в офтальмологии/ Ю.С. Астахов,С.Н.Тульцева // Артериальная гипертензия. — 1999. — Т. 2,
-
-
№1. — С.19-23.
-
Алябьева Ж.Ю. Фармакокинетика рекомбинантной проурокиназы / Ж.Ю. Алябьева, М.Ю. Матвеев, В.Ю. Евграфов, С.П. Домогатский // Вестн. офтальмол. — 1998. -№ 1. — С. 38-41.
-
Бойко Э.В. Оптимизация витреальных вмешательства при гемофтальме. — Автореф. дис…. канд. мед. наук. — СПб: Б.И. — 1994. —21С.
-
Бойко Э.В. Экспериментальное обоснование применения рекомбинантной проурокиназы и ее иммобилизированных форм для лечения послеоперационного фибриноидного синдрома в офтальмологии / Э.В. Бойко, В.Ф. Даниличев, С.В. Кольцова // Бюллетень экспериментальной биологии и медицины. — 1997. — Т. 123, — №2. — С. 201-204.
-
Бойко Э. В. О перспективах применения проурокиназы для лечения гемофтальма и фибриноидного синдрома после ленсвитрэктомии / Э.В. Бойко, В.Ф. Даниличев, С.В. Кольцова, И.Г. Попик// III Российский национальный конгресс «Человек и лекарство» — Тез. Докл. — Москва, 1996. — С.80.
-
Волков В. В. Гемофтальм / В.В., Волков, А.В. Данилов, Е.Г Рапис / Л: 1990. — 38 С.
-
Веселовская З.Ф. Прогнозирование и предупреждение воспалительной реакции после экстракции катаракты с имплантацией искусственного хрусталика: Автореф. дис. д-ра мед. наук. — Одесса, 1989. — 48 С.
-
Гундорова Р. А. Поражение органа зрения при катастрофах / Р. А. Гундорова, А. С. Малаян/М.: 1991.- 54 С.
-
Даниличев В. Ф. Патология глаз. Ферменты и ингибиторы / СПб.: Стройлеспечать, 1996. — 240 С.
-
Даниличев В. Ф., Кольцова С. В., Бойко Э. В. // Офтальмол. Журн. — 1993.
-
№ 5-6. — С. 303-307.
-
Даниличев В.Ф. Травмы и заболевания глаз. Применение ферментов и пептидных биорегуляторов / В.Ф. Даниличев, И.Б. Максимов / Минск: 1994. — 68 С.
-
Даниличев В. Ф. Современная офтальмология: руководство для врачей / СП б: Издательство «Питер», 2000. — 672 С.
-
Имшенецкий А. А. Актуальные проблемы гемостазиологии / М.: 1981.
-
С. 91-98.
-
Кольцова С. В. Растворимые гетеробелковые коньюгаты на основе рекомбинантной проурокиназы для офтальмологии / С.В. Кольцова, Э.В Бойко, Н.П. Кузнецова, В.Ф. Даниличев / Вопросы мед. химии. — 1995. — Т.41, №3. — С. 13-17.
-
Кацнельсон Л.А. Увеиты (клиника, лечение) / Л.А. Кацнельсон, В.Э. Танковский / Москва,4-й филиал Воениздата: 1998. — 208 С.
-
Краснов М. Л. Терапевтическая офтальмология / М. Л. Краснов, Н. Б. Шульпина / Медицина: 1985. — 360 С.
-
Логай И.М. Снижение интенсивности послеоперационной воспалительной реакции на глазах кроликов с помощью водорастворимых антиоксидантов / И.М. Логай, Н.Ф. Леус, Ю.А. Журавок // Офт. жур. — 2003. — №4. — С. 82-87.
-
Михайлец Г. А. Новые лекарственные препараты / Г. А. Михайлец, Б. В. Москвпчёв / М.: 1990. — Вып. 10 — С. 1-8.
-
Петрищев Н. Н. Патологическая физиология системы гемостаза / Н. Н. Петрищев / СПб.: 1990. — 45 С.
-
Ромащенко А. Д. Диагностика и патогенетически ориентированная терапия внутриглазных кровоизлияний: Автореф. Дис. д-ра мед. Наук. — М., 1989.
-
Ставничук Е.З. Экстракапсулярная экстракция катаракты с имплантацией заднекамерного искусственного хрусталика модели Н.М.Сергиенко у взрослых: Автореф. дис. к-та мед. наук. — Одесса, 1989. — 25 с.
-
Танковский В.Э. Тромбозы вен сетчатки / В.Э. Танковский. — М.: 4-й филиал Воениздата, 2000. — 262 с.
-
Тульцева С. Н. Лечение внутриглазных кровоизлияний и фибриновых экссудатов рекомбинантным тканевым активатором плазминогена: Автореферат дис. канд. мед. наук. — 1995.
-
Ткаченко В.И. Основы физиологии человека: учебник для ввузов / В.И. Ткаченко / СПб: 1994. — 1-ый том. — 462 С.
-
Федоров С.Н. Ошибки и осложнения при имплантации искусственного хрусталика / С.Н. Федоров, Э.В. Егорова. — М., 1992. — 247 с.
-
Чазов Е. И. Антикоагулянты и фибринолитические средства / Е.И. Чазов, К.М. Лакин/М.: 1977.- 67 С.
-
Benner J.D. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within seven days reduces outer retinal degeneration /J.D. Benner, A. Hay, M.B. Landers, L.M. Hjelmeland, L.S. Morse / Ophthalmology. — 1994. — Vol. 101, №4. — P. 672-681..
-
Cleary PE. Intravitreal urokinase in the treatment of vitreous haemorrhage / PE. Cleary, E.W G. Davies, J.S. Shilling, A.M. Hamilton // Trans Ophthalmol Soc UK — 1974 -Vol 94 — P.587
-
Dabbs C.K. Complications of tissue plasminogen activator therapy after vitrectomy for diabetes / C.K. Dabbs, T.M. Aaberg, H.E. Aguilar, P.Jr. Sternberg, T.A. Meredith, A.R. Ward //Amer. J. Ophthalmol. — 1990. — Vol. 110, № 4. — P. 354 — 360.
-
Folk J.C. Laser Photocoagulation of the Retina and Choroid / J.C. Folk, J.S. Pulido // American Academy of Ophthalmology. — San Francisco, 1997. — P. 292.
-
Jaffe G. J. Tissue plasminogen activator for postvitrectomy fibrin formation. / G.J. Jaffe, G.W Abrams, G.A. Williams, D.P Han // Ophthalmology 1990 — Vol. 97 P.184.
-
Johnson R.N. Intravitreal tissue plasminogen activator treatment of experimental vitreous hemorrhage / R.N. Johnson, K. Olsen, E. Hernandez // Arch. Ophthalmol. — 1989.
-
Vol. 107, № 6. — P. 891 — 894
-
Min W.K. Resolution of experimental intravitreal fibrin by tissue plasminogen activator / W.K. Min, YB. Kim / Korean. J. Ophthalmol. — 1990. — Vol. 4 № 2. — P. 58-65.
-
Moon J. Treatment of postcataract fibrinous membranes with tissue plasminogen activator / J. Moon, S. Chung, Y Myong, S. Chung, C. Park, N. Baek, S. Rhee// Ophthalmology.
-
1992 — Vol. 99, № 8. — P. 1256 — 1259.
-
Manning L. M., Conrad D. K. //Australian and New Zealand L Ophthalmic. — 1994. -Vol. 22, № 1. — P. 59-63
-
Sellors P.J.H. Intravitreal urokinase in the management of vitreous haemorrhage. / P.J.H. Sellors, J.J. Kanski, D.M. Watson / Trans Ophthalmol Soc UK — 1974 — Vol. 94 — P. 591.
-
Starck T. Low-dose intraocular tissue plasminogen activator treatment for traumatic total hyphema, postcataract, and penetrating keratoplasty fibrinous membranes / T. Starck, L. Hopp, K.S. Held, L.M. Marouf, R.W.J. Yee // Cataract. Refract. Surg. — 1995. — Vol. 21,
№ 2. — P. 219 — 224. -
Tripathi R. C., Tripathi B. J., Park J. K. // Exp. Eye Res. — 1990. — Vol. 51.
-
№ 5. — P. 545-552.
-
Williams J.G. Autologous plasmin enzyme in the surgical management of diabetic retinopathy / J.G. Williams, M.T. Trese, G.A. Williams, M.K. Hartzer // Ophthalmology.
-
-
2001. — Vol. 108, № 10. — P.1902 — 1906.